广东省药品监督管理局正式发布《关于建立粤港澳大湾区内地临床急需进口港澳药品医疗器械预审品种数据库的通告》(以下简称“《通告》”)。同日,粤港澳大湾区内地临床急需进口港澳药品医疗器械预审品种数据库(以下简称预审库)系统正式上线。
据了解,广东省药品监督管理局建立预审库,旨在做好指定医疗机构临床急需进口港澳药品医疗器械(以下简称急需药械)申报服务工作,稳步推进“港澳药械通”政策体系建设,提高急需药械相关品种研究资料可及性,缩短申请资料准备时间,提升境外上市许可持有人政策参与积极性。
《通告》显示,预审库的填报范围包括粤港澳大湾区内地医疗机构临床急需、已在港澳上市的,且不属于麻醉药品、精神药品、兴奋剂目录中的蛋白同化制剂和肽类激素等实施进口准许证管理的药品;港澳公立医院已采购使用、属于临床急需、具有临床应用先进性的医疗器械。填报主体为境外上市许可持有人或者其授权的在中国境内的企业法人。具体填报流程如下: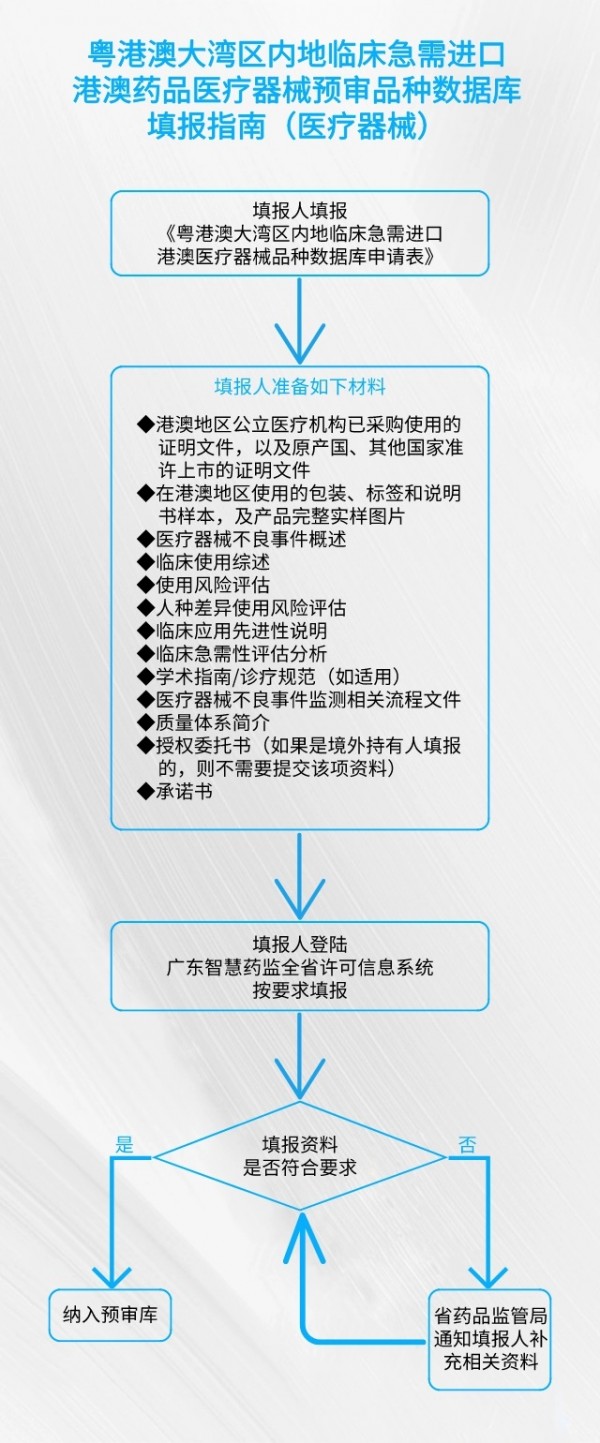
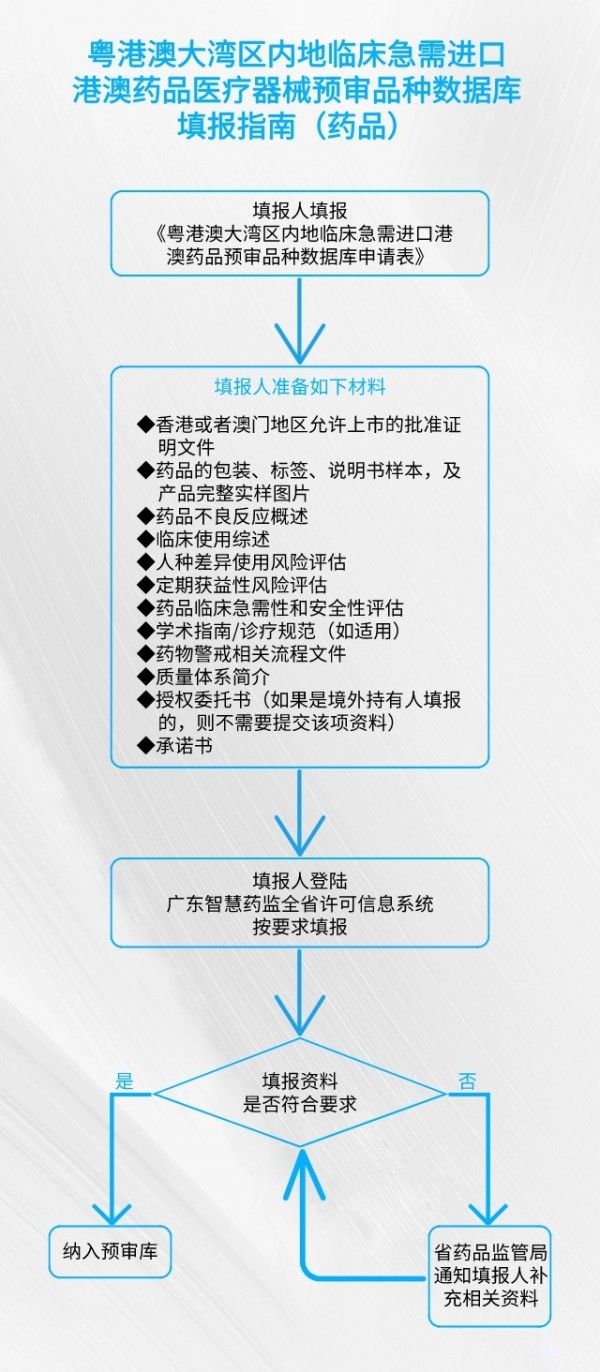
《通告》提出,已纳入预审库的药品、医疗器械,如因已在中国境内获批上市等原因不符合填报范围的,或者因填报人自身原因需退出预审库的,由填报人在系统上提交退库申请,省药品监管局作退出预审库处理。 登入网址 https://tyrz.gd.gov.cn/pscp/sso/static/?redirect_uri=https%3A%2F%2Fqy.gdfda.gov.cn%2Fesso%2Flogin%3Fclient_name%3DGDFDASSO&client_id=gdzhsy