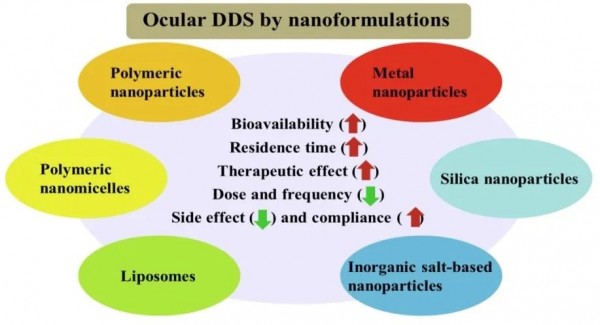
 5、纳米结构脂质载体
5、纳米结构脂质载体
纳米结构脂质载体(NLC)含有大约30%的液体脂质,在固态下缺乏晶体结构。因此,与固体脂质纳米颗粒(SLN)相比,NLC可以在甘油酯的脂肪酸部分之间容纳更多药物。Cys-NLC可以通过与NLCs和硫醇化聚乙二醇单硬脂酸酯 (Cys-PEG-SA)孵育合成,使CsA在兔子的泪液中停留超过6小时而没有刺激。因此,Cys-NLC可能被证明对治疗DED有价值。这些NLC眼用溶液可在角膜表面形成稳定的膜,与基于聚合物的商业人工泪液产品相比,眼表停留良好,这为蒸发型DED模型动物(兔子)的角膜提供了更好的保护。然而,在临床应用之前,还需要进行深入的研究来阐明眼科添加剂的安全性。
6、树枝状聚合物
树枝状聚合物是一种具有径向分支结构的新型聚合物,通常采用围绕核心对称的3D形态。因此它们具有可以封装药物的内部空间,可以充当纳米胶囊。此外,可以通过连接生物相容性聚合物和官能团来装饰树枝状聚合物表面来制备各种功能性树枝状聚合物。因此,树枝状聚合物具有治疗DED的潜在应用。例如,基于聚酰胺胺(PAMAM)的二价水溶性树枝状聚合物显示出对基质的高亲和力可以达到nM水平,这些制剂的功效也在兔子实验性DED系统中得到证明。此外,已经研究了树枝状聚合物-地塞米松偶联物在DED治疗中的用途。然而,其长期安全性尚未在眼部得到充分证实,需要进一步的安全性评估。
7、聚合物
壳聚糖是一种存在于甲壳类动物外骨骼中的阳离子聚合物,具有生物粘附特性。滴注载有CsA的壳聚糖纳米颗粒的兔角膜和结膜中的CsA水平明显高于含有CsA的壳聚糖溶液/悬浮液。此外,壳聚糖包被的CsA脂质体装饰有带正电荷的聚合物壳聚糖,也被认为可以延长药物停留时间并增强药物/纳米载体从膜表面的渗透。在一项研究中,制备了携带编码修饰的MUC5AC蛋白质粒的阳离子化明胶纳米粒子,通过评估健康小鼠和实验性DED模型小鼠中pMUC5AC纳米粒子的递送能力,实验组小鼠中修饰的MUC5AC表达升高,炎症减少,泪液产生得到改善。PLGA是聚乳酸和聚乙醇酸的合成共聚物,以其生物相容性和生物降解性而著称。因此也常用于药物输送系统以治疗眼部疾病。使用纳米沉淀法生成的苯基硼酸修饰的PLGA纳米颗粒中的CsA在治疗DED小鼠模型中也非常有效 。
8、纳米晶片
纳米晶片装载的药物可逐渐从圆盘中释放出来。用于制备纳米晶片的聚合物已被FDA批准供人类使用。因此,该技术可应用于临床研究并在人体中进行测试。即使不断眨眼,纳米晶片也会粘附在眼表上,且透明度不会影响正常视力。纳米晶片中携带的药物会在泪液中溶解缓慢,药物长效释放。研究表明含有地塞米松和羧甲基纤维素的纳米晶片(每天一次,持续5天)的治疗效果与地塞米松滴眼液(每天两次)的治疗效果相似。这些发现表明纳米晶片是治疗眼部疾病的一种有吸引力的选择。
9. 其他产品
一项研究中使用凝胶状甲基丙烯酸酯和透明质酸生产了一种透镜状可生物降解药物递送材料,4℃时稳定,37℃时降解。接触泪液后该材料逐渐降解,进行药物输送。透镜型可生物降解药物递送材料可以使用 3D 打印机制造。未来需要进一步研究以确保镜片的可见度以及降解后保持恒定的药物浓度。
环糊精可以增加药物在泪液中的溶解度和释放时间,并改善药物渗透和生物利用度。据报道,使用这些环糊精制备的CsA滴眼液、他克莫司、依碳酸氯替泼诺和OCS-02(抗 TNF-a 抗体)可有效治疗DED。
粘液渗透颗粒 (MPPs)是一种涂层纳米颗粒,对粘蛋白的亲和力低,能够穿过粘液屏障。KPI-121(0.25%)是一种眼用混悬液,它利用这种策略将依碳酸氯替泼诺有效地沉积到眼组织中,与安慰剂相比可明显减轻DED的症状和体征。已经于2020年获得FDA批准。